| Vi sono un centinaio
di elementi chimici naturali e circa 300 isotopi nel sistema
solare. Gli elementi più pesanti del ferro sono prodotti quando
l'idrogeno fonde in elio, l'elio in carbonio e l'ossigeno negli
elementi più pesanti. Circa tutti i nuclei più pesanti
dell'elio sono prodotti in reazioni nucleari all'interno delle
stelle. Nelle stelle più vecchie la frazione di massa degli
elementi pesanti è solo circa lo 0.02%, mentre nelle stelle più
giovani è qualche percento. Comunque la maggior parte del
materiale stellare è idrogeno ed elio. Secondo il modello
cosmologico standard questi elementi si sono formati negli
stadi iniziali dell'Universo quando temperatura e densità erano
opportune per avviare le reazioni nucleari. L'elio è prodotto
anche durante la sequenza principale dell'evoluzione stellare,
ma molto poco è rimesso nello spazio per essere incorporato in
successive generazioni di stelle. La maggior parte è
trasformato in elementi più pesanti da successive reazioni o
rimane impriogionato all'interno dalle nane bianche compatte.
Allora l'abbondanza di elio non cresce molto a causa dei
processi stellari.
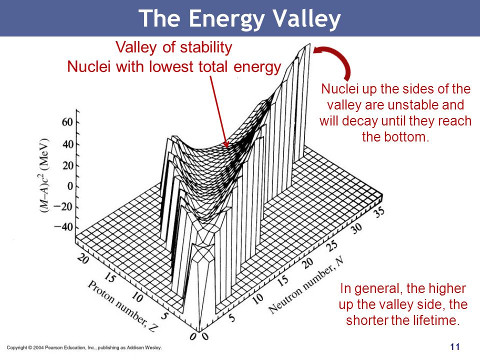
Le reazioni nucleari che conducono alla costruzione dei nuclei pesanti fino al ferro si innescano all'interno delle stelle (↑). La formazione degli elementi più pesanti del ferro richiede un notevole apporto di energia e non possono essere ottenuti dalle reazioni nucleari all'interno delle stelle. Ma tuttora i nuclei pesanti sono continuamente prodotti. Nel 1952 il tecnezio è stato scoperto nell'atmosfera delle giganti rosse. Il tempo di vita dell'sotopo più longevo 98Tc è circa 1.6 miliardi di anni cosicchè il tecnezio osservato deve essere stato prodotto dalla stella. In effetti la maggior parte dei nuclei più pesanti del ferro sono formati da processi di cattura neutronica. Poichè i neutroni non hanno carica elettrica possono facilmente penetrare nei nuclei. La probabilità per la cattura neutronica dipende sia dall'energia cinetica del neutrone incidente sia dal numero di massa del nucleo. Nella cattura neutronica un nucleo con numero di massa A è trasformato in un nucleo più pesante secondo la reazione: Il nuceo appena formato può essere instabile a causa del decadimento β dove un neutrone è trasformato in un protone: Due tipi di processi di cattura neutronica si sono incontrati a secondo del valore del flusso di neutroni. Nel lento processo-s (slow) il flusso di neutroni è così piccolo che qualsiasi decadimento β ha avuto il tempo di accadere prima che si avvii la prossima reazione di cattura neutronica. La maggior parte dei nuclei stabili al sopra il numero di massa 210 sono formati per mezzo del processo-s. Quando il flusso di neutroni è grande , il decadimeto β non ha il tempo di avviarsi prima della prossima cattura neutronica. Si parla allora di un processo-r rapido che dà luogo a molti isotopi ricchi di neutroni. Un flusso di neutroni sufficiente per il processo-s è ottenuto nel corso della normale evoluzione stellare. Per esempio alcune reazioni di fusione del carbonio e dell'ossigeno producono neutroni liberi. Se vi è convezione tra i gusci che stanno fondendo di idrogeno e elio, protoni liberi possono essere portati negli strati ricchi di carbonio. Allora le seguenti reazioni a catena che producono neutroni diventano importanti: 12C + p → 13N + γ 1313N → 13C + e+ + νe C + 4He → 16O + n La convezione può anche portare i prodotti di reazione vicino alla superficie. Il flusso di neutroni richiesto per i processi-r è circa 1022 cm-3, che è molto grande per essere prodotto durante la normale evoluzione delle stelle. Il solo posto al presente conosciuto dove è previsto un flusso di neutroni sufficientemente grande è vicino alla stella di neutroni che si forma durante l'esplosione delle supernove. In questo caso, la rapida cattura neutronica produce nuclei che non possono più catturare neutroni senza diventare fortemente instabili. Dopo uno o più rapidi decadimenti β il processo continua. Il processo-r si ferma quando il flusso di neutroni decresce. i nuclei prodotti allora gradualmente decadono a causa dei decadimenti β verso isotopi più stabili. Poichè i percorsi dei processi-r arrivano a circa dieci unità di massa sotto la valle di stabilità, il picco di abbondanza prodotto diminuisce di circa dieci unità sotto quello dei processi-s. Gli elementi più pesanti naturali come uranio, torio e plutonio sono formati dai processi-r.
|
||||