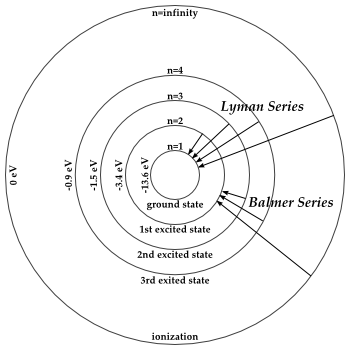
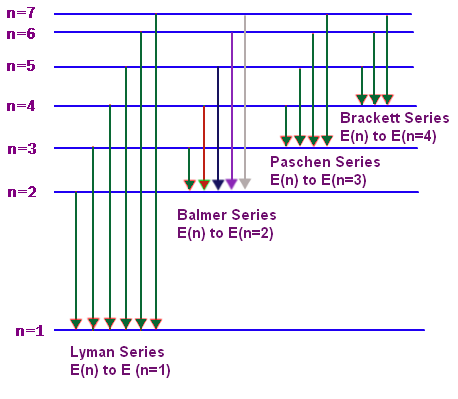
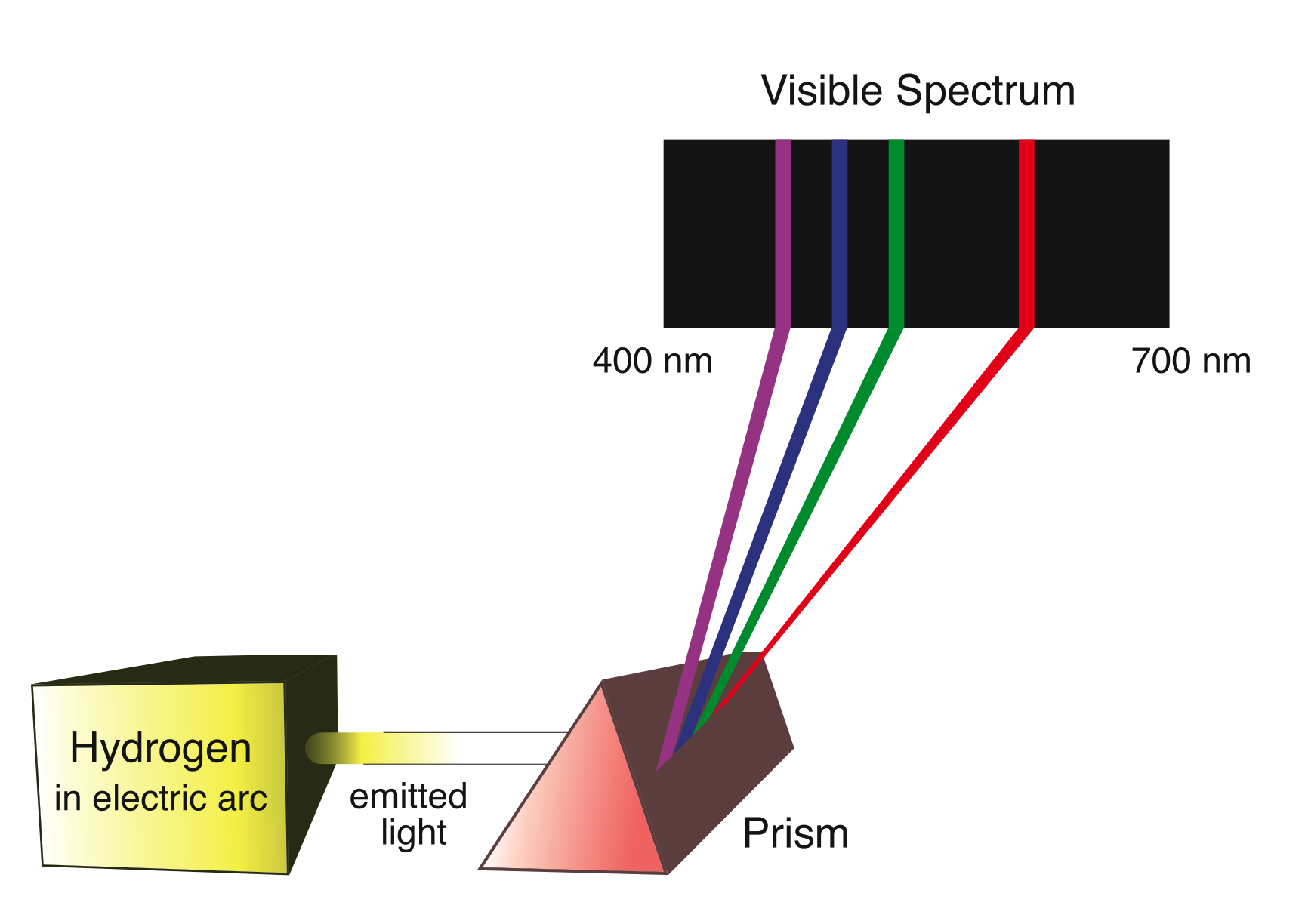
Uno dei fenomeni più evidenti e inspiegabili alla luce della fisica classica è stato l'osservazione di spettri di assorbimento e di emissione a righe degli elementi e composti chimici. Sulla base della spiegazione della radiazione del corpo nero di Planck, dell'interpretazione dell'effetto fotoelettrico di Einstein e del modello atomico proposto da Rutherford, nel 1913 Bohr elaborò un modello teorico semiclassico che spiegava molto bene lo spettro di emissione e di assorbimento dell'atomo di idrogeno. Il modello è semiclassico perchè sono ancora presenti concetti classici come traiettoria del moto e velocità ma anche tre postulati che sono in contraddizione con le previsioni della fisica classica.
I tre postulati sono:
- Nell'atomo esistono per gli elettroni orbite stabili. Questo implica che se un elettrone si trova in un'orbita stabile non irradia onde elettromagnetiche.
- Se un elettrone effetta una transizione da un'orbita stabile Ei ad un'altra orbita stabile Ef irradia un'onda elettromagnetica di frequenza
- L'elettrone in un'orbita stabile possiede un momento angolare
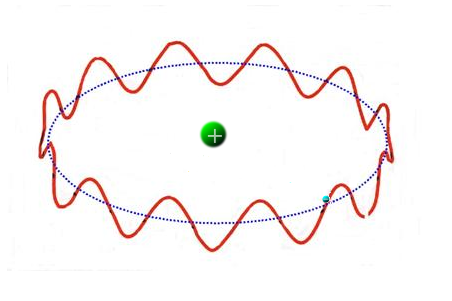
Successivamente, anche a causa del successo del modello di Bohr, De Broglie formulò l'ipotesi che ad ogni oggetto quantistico dotato di massa (e quindi di quantità di moto) debba attribuirsi un'aspetto ondulatorio con lunghezza d'onda . Se valida questa ipotesi il terzo postulato appare più chiaro perchè, se si rappresenta l'oggetto quantistico "elettrone" mediante un'onda stazionaria di lunghezza d'onda , il postulato si deduce direttamente considerando un'orbita classica circolare,
Ecco il ragionamento seguito in forma semplificata.
L'elettrone è in orbita stabile (supposta) circolare perchè è soggetto alla forza centripeta elettrostatica
Applicando la Seconda Legge della Dinamica , si ha:
Dal terzo postulato si può ricavare il raggio orbitale : e sostituirlo nella precedente applicazione della II Legge:
così è trovata la velocità orbitale. Nota la velocità si può ricavare il raggio:
C è una costante. Per ogni n esiste un' energia possibile dell'atomo di idrogeno. Per esempio se n=1 abbiamo il livello fondamentale a cui corrisponde un'energia di -13.6 eV.
dal secondo postulato abbiamo la produzione di un'onda elettromagnetica quantizzata (fotone) di frequenza:
e di lunghezza d'onda :
R è la costante di Rydberg, R= 1.097·107 m-1